Επίκεντρο της έρευνας
Η Ομάδα Μεταφραστικής Νευρολογίας (Group of Translational Neurology, GTN) δημιουργήθηκε το 2018 από τον Επισκέπτη Καθηγητή Αθανάσιο Λουρμπόπουλο (Επικεφαλή Ομάδας) σε συνεργασία με τον Καθηγητή Ιορδάνη Μουρούζη, υπό την υποστήριξη του Καθηγητή Κωνσταντίνου Πάντου (Διευθυντή του Τμήματος).
Η Ομάδα επικεντρώνεται στην εύρεση φαρμάκων και τρόπων προώθησης της αναγέννησης και της πλαστικότητας μετά από εγκεφαλικό, χρησιμοποιώντας μακροχρόνιο (χρόνιο) πειραματικό εγκεφαλικό επεισόδιο σε μεταφραστική βάση. Χρησιμοποιούμε το μοντέλο της απόφραξης της μέσης εγκεφαλικής αρτηρίας (fMCAo) σε ποντίκια μαζί με εκτεταμένη νευροσυμπεριφορική φαρέτρα κατάλληλων δοκιμασιών. Μελετάμε τα ζώα σε όλες τις φάσεις μετά το εγκεφαλικό (από λίγες ώρες έως και 6 μήνες μετά την ισχαιμική βλάβη) προσπαθώντας να ανακαλύψουμε προσεγγίσεις που προσδίδουν μακροπρόθεσμα κλινικά οφέλη στα ζώα. Η μικροσκοπία (φθορισμού, οπτική, συνεστιακή) και οι μοριακές και νευροανοσολογικές μέθοδοι είναι τα κύρια εργαλεία μελέτης. Διεπιστημονικές συνεργασίες (συνθετική χημεία, μέθοδοι πληροφορικής και τεχνητής νοημοσύνης) παρέχουν περαιτέρω υποστήριξη στο έργο μας.
Η Ομάδα μας είναι η μοναδική στην Ελλάδα που χρησιμοποιεί το συγκεκριμένο μοντέλο εγκεφαλικών (fMCAo).
Μερικά από τα κύρια ερευνητικά μας πεδία στο εγκεφαλικό είναι:
1. Μεταφραστική έρευνα με μοντελοποίηση του χρόνιου εγκεφαλικού
Το ισχαιμικό εγκεφαλικό είναι μία από τις τρεις πιο κοινές αιτίες θανάτου και η πιο κοινή αιτία αναπηρίας στις βιομηχανικές χώρες. Παρά τη σημαντική έρευνα, περισσότερο από το 90% των ασθενών με εγκεφαλικό δεν λαμβάνουν αιτιολογική θεραπεία. Αυτό το μειονέκτημα πιθανότατα πηγάζει από την αδυναμία να μεταφραστούν καλά κατανοητές, θεραπευτικά εκμεταλλεύσιμες, έννοιες από το εργαστήριο στην κλινική πράξη. Αυτός είναι ο λεγόμενος "μεταφραστικός φραγμός" στην έρευνα για τα εγκεφαλικά επεισόδια (Lourbopoulos A et al, Front Neuroscience 2021, doi: 10.3389/fnins.2021.652403).
Με βάση τα παραπάνω, δημιουργήσαμε στο Ινστιτούτο Έρευνας για Εγκεφαλικό και Άνοια (ISD) στο Μόναχο και εφαρμόσαμε στην Ομάδα μας στην Αθήνα ένα πρωτόκολλο υποστήριξης των πειραματοζώων ("mouse Stroke-Unit", mSU) που μεγιστοποιεί τη μεταφραστική αποτελεσματικότητα του μοντέλου εγκεφαλικού μας (Lourbopoulos A et al, JCBFM 2017, doi: 10.1177/0271678X16660986). Έχουμε αποδείξει ότι μία θεραπεία μπορεί να θεωρείται προστατευτική μόνο αν επηρεάζει την πρωτογενή εγκεφαλική βλάβη και το εστιακό συμπεριφορικό αποτέλεσμα σε εγκεφαλικά ζώα, ανεξάρτητα από την επίδραση της θεραπείας στη θνησιμότητα και/ή στα επακόλουθα του εγκεφαλικού στα άλλα όργανα. Η ιδέα του mSU είναι η βάση για τη διεξαγωγή μελετών μεγάλων εμφράκτων κάτω από συνθήκες υψηλής κλινικής μετάφρασης (προσομοιάζοντας κατά κάποιο τόπο ανθρώπινη μονάδα εγκεφαλικού επεισοδίου) με μεγιστοποιημένες μεταφραστικές πιθανότητες στις κλινικές.
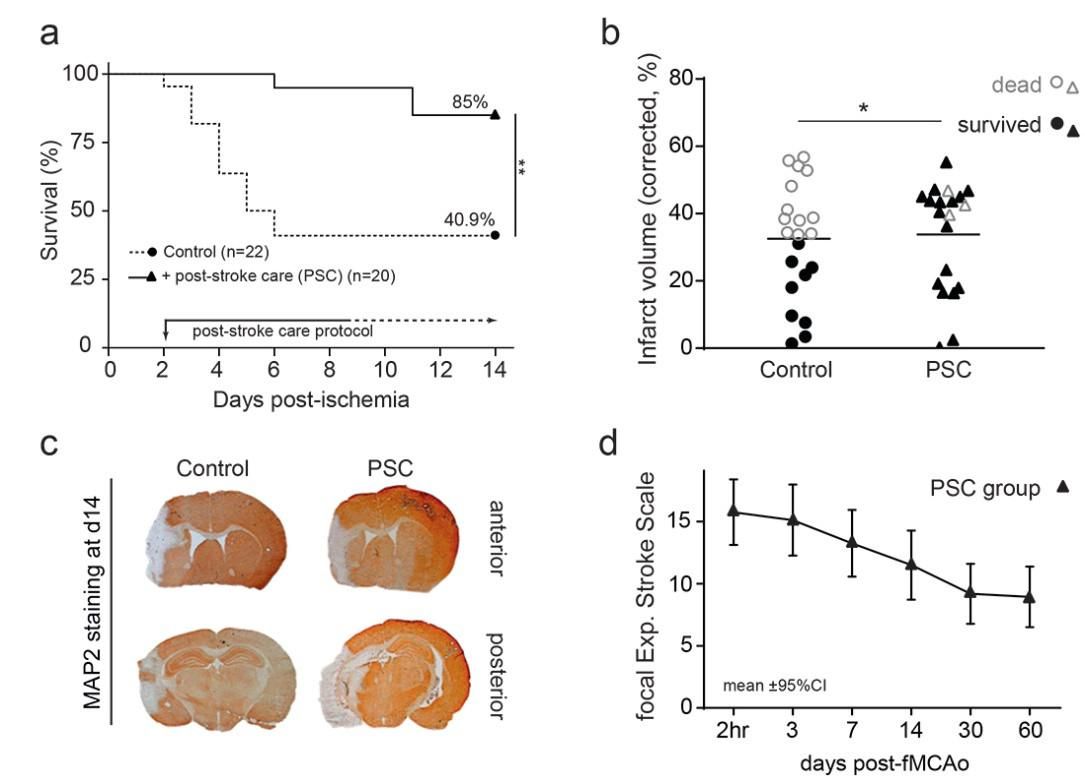
Εικόνα 1. Η φροντίδα μετά το εγκεφαλικό επεισόδιο (PSC) για ποντίκια μειώνει τη θνησιμότητα από fMCAo, χωρίς επίδραση της κύριας ισχαιμικής παθολογίας.
Το διάγραμμα επιβίωσης Kaplan-Meier (α) δείχνει ότι το mSU (ομάδα PSC) διπλασίασε το ποσοστό επιβίωσης 14 ημερών σε σύγκριση με τα ποντίκια ελέγχου. Είναι σημαντικό ότι διέσωσε ζώα με μεγάλα έμφρακτα (b) (όγκος εμφράγματος >35% του ημισφαιρίου -μαύρα τρίγωνα γεμάτα- της ομάδας PSC), χωρίς να αλλάξει τα έμφρακτά τους μέχρι την ημέρα 14. Αντιπροσωπευτικές τομές εγκεφάλου βαμμένες με MAP2 (c), που δείχνουν έμφρακτο αριστερού ημισφαιρίου (λευκός ιστός στο αριστερό ημισφαίριο) και ατροφία. Προφανώς, τα ζώα με μεγάλα έμφρακτα δεν πεθαίνουν όταν υποστηρίζονται με το mSU και έχουν χρόνια αυτογενή ανάρρωση περίπου 40% (focal Experimental Stroke Scale), η οποία είναι μεταφραστική προς την αντίστοιχη κλινική κατάσταση στους ανθρώπους (d). Οι οριζόντιες γραμμές στο b αντιπροσωπεύουν τις μέσες τιμές. *p<0,05; **p<0,01. (από: Lourbopoulos A et al, JCBFM 2017)
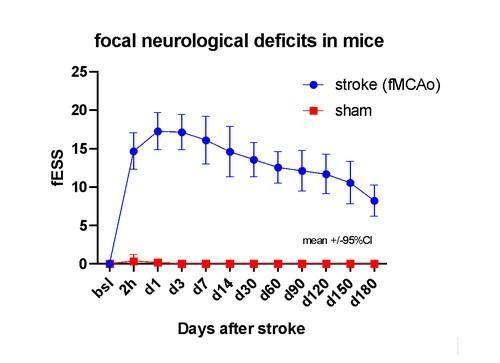
Πρόσφατα δείξαμε ότι το mSU μπορεί να επιτρέψει σε ποντίκια με μεγάλα εγκεφαλικά και έντονα εστιακά νευρολογικά ελλείμματα (τα οποία θα πέθαιναν χωρίς υποστήριξη mSU) να επιβιώσουν για μήνες μετά το εγκεφαλικό και να καταδεικνύουν εστιακά νευρολογικά ελλείμματα. Αυτό επιτρέπει για πρώτη φορά μελέτη των υπερχρόνιων βλαβών του εγκεφαλικού, όπως φαίνεται παρακάτω στην Εικόνα 2.
Εικόνα 2. Η υποστήριξη των ζώων μέσω mSU επιτρέπει την εξαιρετικά μακροχρόνια μελέτη σοβαρών εστιακών νευρολογικών ελλειμμάτων σε ποντίκια. Τα ζώα ελέγχου (sham, χωρίς εγκεφαλικό) δεν παρουσιάζουν ελλείμματα. Η μελέτη διεξήχθη με τυχαιοποιημένο, τυφλό από τον αξιολογητή, τρόπο μέχρι το τέλος (6 μήνες μετά το εγκεφαλικό) της περιόδου παρατήρησης. Τα νευρολογικά ελλείμματα αξιολογήθηκαν μέσω της focal Experimental Stroke Scale (εδώ το εστιακό της στοιχείο, fESS).
Το αναλυτικό πρωτόκολλο υποστήριξης των πειραματοζώων μετά από πειραματικό εγκεφαλικό (“mouse Stroke-Unit”) μπορείτε να το βρείτε εδώ.
2. Ανάλυση ισχαιμικών βλαβών με αλγορίθμους τεχνητής νοημοσύνης
Η μέτρηση του όγκου ενός ισχαιμικού εμφράκτου σε πειραματικά μοντέλα εγκεφαλικού βασίζεται συνήθως σε επίπονες και χρονοβόρες χειρονακτικές μετρήσεις, σε ειδικά χρωσμένες τομές ιστού. Η πιο συχνά χρησιμοποιούμενη χρώση για την ανίχνευση εγκεφαλικού είναι το 2,3,5-Triphenyltetrazolium chloride (TTC) σε παχιές τομές εγκεφάλου, ακολουθούμενη από χρώση Nissl ή Cresyl Violet, ανοσοχρώση MAP2 ή λιγότερο συνηθισμένες χρώσεις (HSP72, HSP27) λεπτών εγκεφαλικών τομών. Αυτές οι χειρονακτικές μετρήσεις, παρά την ευρεία εφαρμογή και την αξία τους, είναι εξαιρετικά υποκειμενικές και επιρρεπείς σε ανθρώπινο λάθος. Ταυτόχρονα, δεν παρέχουν καμία νευροανατομική πληροφορία για τις ισχαιμικές περιοχές στον εγκέφαλο.
Σε συνεργασία με το Τμήμα Ηλεκτρολόγων Μηχανικών και Μηχανικών Υπολογιστών του Πανεπιστημίου Πατρών, αναπτύξαμε και χρησιμοποιούμε ένα σύστημα βασισμένο σε τεχνολογία τεχνητής νοημοσύνης (μοντέλα μηχανικής μάθησης) για ογκομετρική ανάλυση του εμφράκτου και νευροανατομική χαρτογράφηση των εγκεφαλικών βλαβών, σε τομές χρωματισμένες με TTC. Ονομάζουμε το σύστημά μας "StrokeAnalyst" (SA) (Damigos G et al, JCBFM, 2022, doi: 10.1177/0271678X221083387). Ανιχνεύει γρήγορα, αξιόπιστα, αμερόληπτα και αυτοματοποιημένα την περιοχή του εμφράγματος (χωρίς ψευδώς-θετική, threshold-dependent, συμπερίληψη φυσιολογικού ιστού), όπως φαίνεται παρακάτω στην Εικόνα 3.
Ο StrokeAnalyst (SA) βρίσκεται επί του παρόντος υπό περαιτέρω ανάπτυξη και σε χρώσεις ιστολογίας.
Ο StrokeAnalyst» δουλεύει σε εικόνες JPEG/Tiff οποιαδήποτε ανάλυσης και πηγής:
- σκαναρισμένες σε 300-2400dpi,
- εικόνες από κινητό,
- εικόνες ληφθείσες από δημοσιευμένα άρθρα (>300dpi).
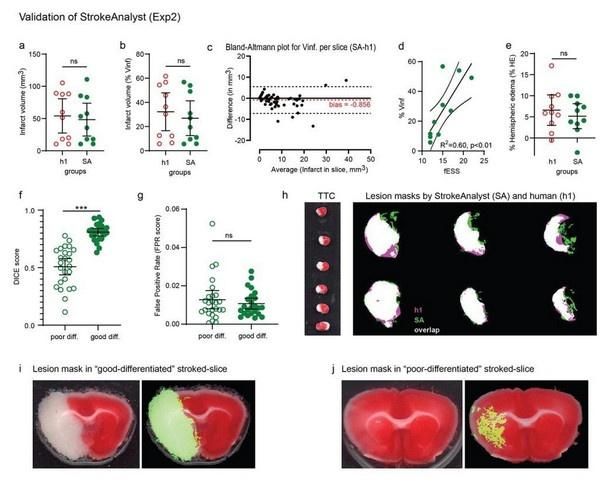
Εικόνα 3. Αποτελέσματα SA στο πείραμα επικύρωσης (Exp2) σε σύγκριση με τη χειρονακτική ογκομέτρηση. Οι όγκοι εμφράγματος που μετρώνται με SA σε mm3 (a) ή ως ποσοστό % του αριστερού ημισφαιρίου (b) είναι παρόμοιοι με εκείνους της χειρονακτικής ογκομετρίας (h1). Η γραφική παράσταση Bland-Altman για όγκους εμφράγματος ανά μεμονωμένες τομές (c) δείχνει σχεδόν μηδενική μεροληψία του SA σε σύγκριση με το h1. Οι όγκοι εμφράγματος (ως % Vinf) και πάλι συσχετίζονται γραμμικά με τις τιμές fESS ανά ζώο (d). Τα ημισφαιρικά οιδήματα ως ποσοστό % είναι επίσης παρόμοια με τις ανθρώπινες μετρήσεις (e). Τα dice-scores (f) και τα ποσοστά ψευδώς θετικών (FPR, g) για μάσκες SA- έναντι h1, κατηγοριοποιημένα ανά ποιότητα χρώσης TTC (κακή/καλή διαφοροποίηση), δείχνουν και πάλι ότι το SA αποδίδει καλύτερα σε καλές διαφοροποιημένες τομές TTC. Το SA έχει σταθερά πολύ χαμηλό ποσοστό FPR τόσο σε κακώς όσο και σε καλές «διαφοροποιημένες» τομές, υποδεικνύοντας υψηλή ειδικότητα για βλάβες εμφράκτου. Αντιπροσωπευτικές προβολές επικάλυψης (λευκό) των μασκών SA (πράσινες) και h1 (ροζ) φαίνονται στο (h). Αντιπροσωπευτικές τομές TTC με καλή και κακή χρωματική διαφοροποίηση μεταξύ ισχαιμικού και υγιούς ιστού, με τις αντίστοιχες μάσκες αλλοιώσεων SA, απεικονίζονται στα (i) και (j) αντίστοιχα.
3. Μελέτη των δράσεων της Τ3 ως θεραπευτικής προσέγγισης για την μικροαγγειακή δυσλειτουργία και πολυοργανική ανεπάρκεια που προκαλεί η σήψη.
Σε συνεργασία με το Group of Novel Pharmacological Approaches for Cardiovascular Disease μελετάμε τις δράσεις του T3 για τη μικροαγγειακή δυσλειτουργία που προκαλείται από σήψη. Η μελέτη πραγματοποιείται σε in vivo μοντέλο περιτονίτιδας (απολίνωση και διάτρηση του τυφλού εντέρου) σε ποντίκια, και γίνεται σε συνεργασία με την εταιρεία Uni-Pharma Pharmaceutical Laboratories. Η παρουσία ιστικής υποξίας σε διάφορα όργανα μελετάται με μια καινοτόμο μέθοδο ανοσοϊστοχημείας που βασίζεται στην πιμονιδαζόλη. (Mourouzis I, Lourbopoulos A, Intensive Care Med Exp. 2021, doi: 10.1186/s40635-021-00382-y).
Υπεύθυνος Επικοινωνίας #1