Επίκεντρο της έρευνας
Επίκεντρο της έρευνας της ομάδας αποτέλεσε για πολλά χρόνια η διερέυνηση του θεραπευτικού ρόλου της Θυρεοειδικής Ορμόνης στην ιστική επιδιόρθωση.
Μέρος των αποτελεσμάτων της έρευνάς αυτής μεταφράστηκαν στην κλινική πράξη με την κλινική μελέτη φάσης ΙΙα (Thy-Repair, EudraCT:2016-000631-40). Η μελέτη Thy-Repair αφορά την αποτελεσματικότητα της τριιωδοθυρονίνης ως νέας θεραπευτικής προσέγγισης για την ιστική επιδιόρθωση σε ασθενείς με οξύ έμφραγμα του μυοκαρδίου που υποβάλλονται σε επαναιμάτωση με πρωτογενή αγγειοπλαστική.
Από το 2010, το επίκεντρο της έρευνητικής προσπάθειας της ομάδας αποτέλεσε η ανάδειξη του θυρεοειδικού υποδοχέα TRα1 ως νέου φαρμακολογικού στόχου για επιδιόρθωση/αναγέννηση της ιστικής βλαβης. Οι μελέτες αυτές ανέδειξαν για πρώτη φορά οτι: α) το στρές του μυοκαρδίου οδηγεί σε μετακίνηση του TRα1 στον πυρήνα και τον μετατρέπει σε μοριακό ρυθμιστή της ιστικής επιδιόρθωσης ανάλογα με τα υπάρχοντα επίπεδα της Τ3, β) η Τ3 ασκεί καρδιοπροστατευτική δράση στη βλάβη ισχαιμίας-επαναιμάτωσης μέσω ενεργοποίησης του κυτοσολιακού TRα1 υποδοχέα, γ) Η υπορύθμιση του πυρηνικού TRα1 υποδοχέα καθώς και η χορήγηση ειδικού αναστολέα του TRα1 μετά από έμφραγμα έχoυν ως αποτέλεσμα τη σημαντική επιδείνωση της καρδιακής ανεπάρκειας.
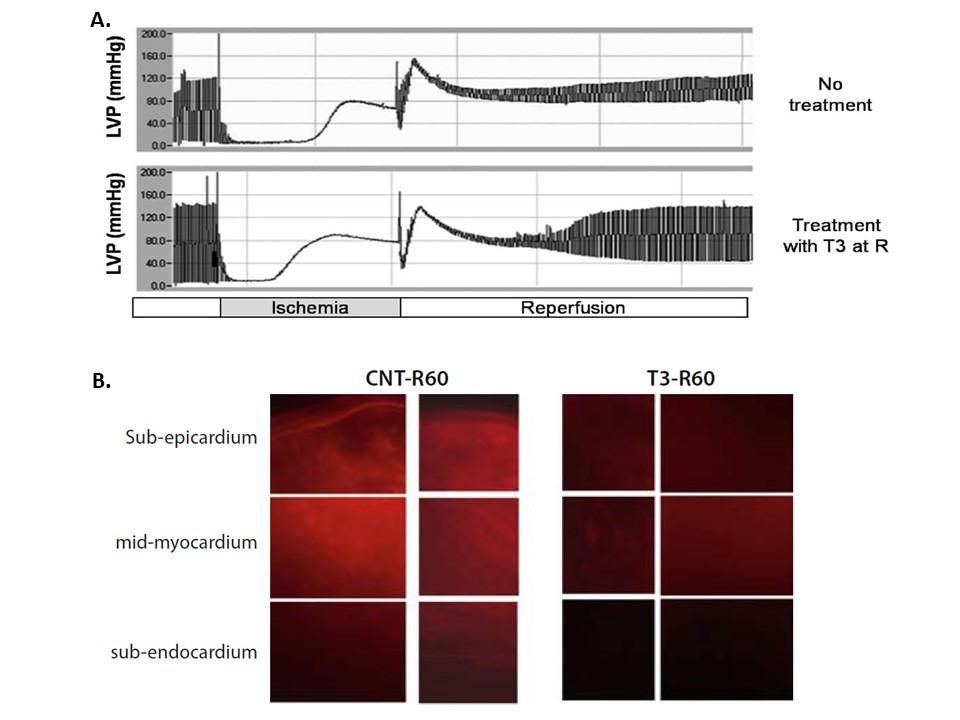
Εικόνα 1. Η Θυρεοειδική Ορμόνη βελτιώνει την καρδιακή λειτουργία ενώ περιορίζει την απόπτωση σε κατάσταση ισχαιμίας - επαναιμάτωσης. Αυτό μπορεί να είναι ένα μοναδικό παράδειγμα ενός παράγοντα με αντι-αποπτωτικές δράσεις. (α) Καταγραφές πιέσεως της αριστερής κοιλίας από συσκευή απομονωθείσας καρδιάς αρουραίου-Langendorff που υπόκεινται σε ισχαιμία και επαναιμάτωση χωρίς θεραπεία (no treatment) και με Τ3 θεραπεία (40 μg/l) στην επαναιμάτωση (treatment with Τ3). (β) Εικόνες μικροσκοπίας που δείχνουν τη δραστικότητα κασπάσης-3 που ανιχνεύεται από ειδική φθορίζουσα ουσία σε καρδιές που δεν έχουν υποβληθεί σε θεραπεία και μετά από χορήγηση Τ3. Ο ιχνηθέτης ήταν μια προσφορά της εταιρείας Quidd (Γαλλία).
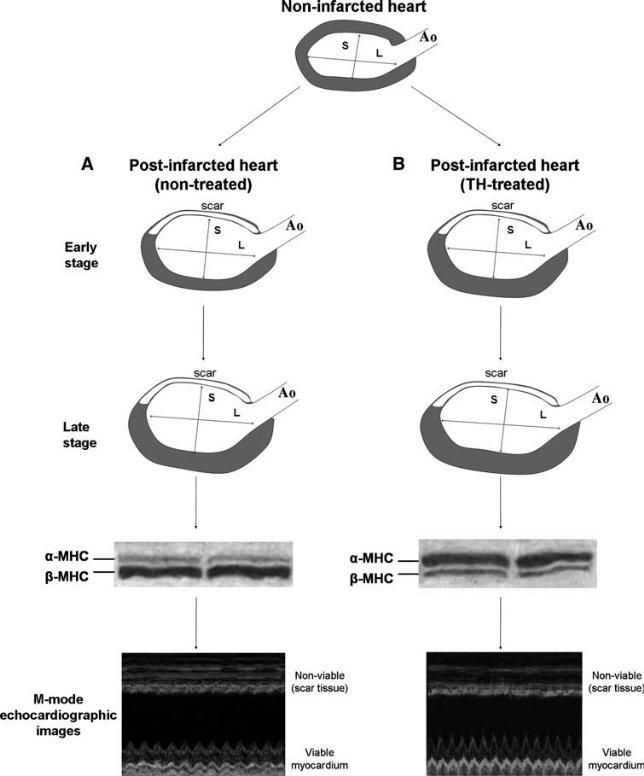
Εικόνα 2. Σχηματική απεικόνιση των αλλαγών στη γεωμετρία της αριστερής κοιλίας της καρδιάς και του πάχους του τοιχώματος μετά από έμφραγμα σε που χορηγήθηκε ΘΟ και αυτές που δεν έλαβαν αγωγή. α) Η αριστερή κοιλία διατείνεται και γίνεται σφαιρική μετά το έμφραγμα στις καρδιές χωρίς αγωγή, και η υπερτροφία αναπτύσσεται σε μεταγενέστερο στάδιο. Ο λόγος του επιμήκους άξονα (L) προς τον μέγιστο βραχύ άξονα (S) της αριστερής κοιλίας μειώνεται και η έκφραση της βαριάς αλυσίδας μυοσίνης τύπου β (β-MHC) αυξάνεται ενώ η α-MHC μειώνεται, με αποτέλεσμα μειωμένη συστολική λειτουργία του βιώσιμου τμήματος του μυοκαρδίου.
(β) Η θεραπεία με ΘΟ επαναφέρει την αριστερή κοιλία προς το φυσιολογικό ελλειψοειδές σχήμα. Η υπερτροφία αναπτύσσεται νωρίτερα με αυξημένη α-MHC και μειωμένη έκφραση β-MHC και έχει ως αποτέλεσμα την ομαλοποίηση του τοιχώματικού στρές στα αρχικά στάδια. Η συστολική λειτουργία του βιώσιμου μυοκαρδίου που αξιολογείται υπερηχοκαρδιογραφικά βελτιώνεται σημαντικά. Ao = Aorta (Heart Fail Rev (2010) 15:143–154)
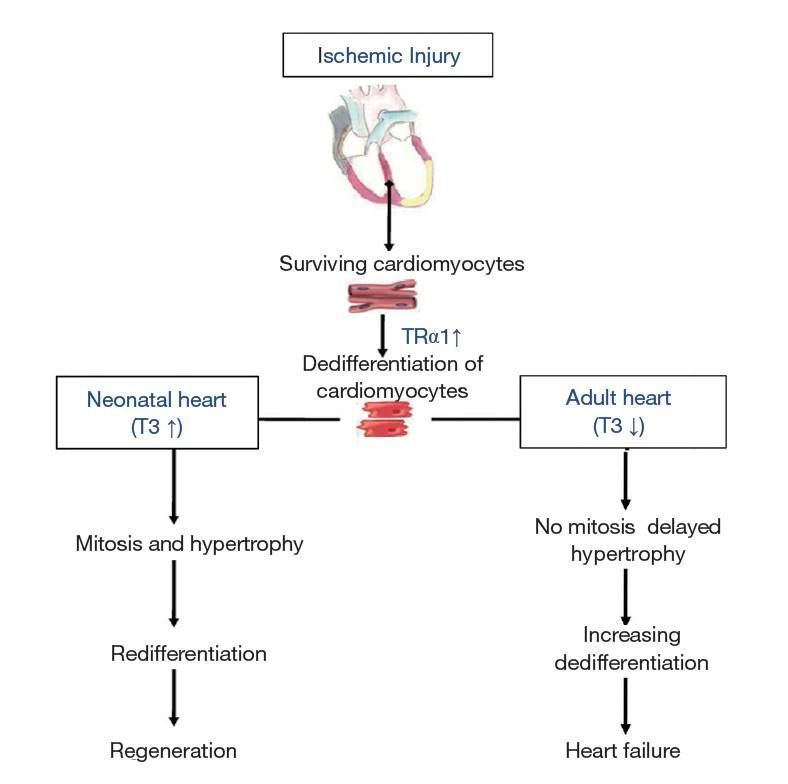
Εικόνα 3. Οι αλλαγές στη σηματοδότηση των θυρεοειδικών ορμονών καθορίζουν την απόκριση της καρδιάς μετά από ισχαιμικό τραυματισμό. Η αρχική απόκριση της ενήλικης καρδιάς στη βλάβη περιλαμβάνει αυξημένη έκφραση του υποδοχέα θυρεοειδικής ορμόνης α1 (TRα1) που συμβάλλει στην αποδιαφοροποίηση. Σε αυτό το πλαίσιο, η χαμηλή Τ3 μπλοκάρει την αναγεννητική απόκριση και οδηγεί σε αυξανόμενη αποδιαφοροποίηση, δυσλειτουργία και καρδιακή ανεπάρκεια. Ωστόσο, τα υψηλά επίπεδα Τ3 σε συνδυασμό με την αυξημένη έκφραση του TRα1 (όπως για παράδειγμα στη νεογνική καρδιά) οδηγούν σε αυξημένη καρδιακή μάζα (πολλαπλασιασμός και υπερτροφία), επαναδιαφοροποίηση και αναγέννηση ως απάντηση στο ισχαιμικό στρές. (Ann Transl Med. 2018 Jun; 6(12): 254.) ↑, Αύξηση; ↓, Μείωση
Τα αποτελέσματα αυτά οδήγησαν στο σχεδιασμό και τη σύνθεση αναλόγων της τριιωδοθυρονίνης με πιθανή εκλεκτική δράση αγωνιστή του TRα1 υποδοχέα.
Στην παρούσα φάση η βασική ερευνητική δραστηριότητα της ομάδος εστιάζεται στα παρακάτω καινοτόμα πεδία:
1. Η κλινική μελέτη φάσης ΙΙα (Thy-Repair, EudraCT:2016-000631-40) ολοκληρώθηκε το Δεκέμβριο του 2020 με θετικά αποτελέσματα στην καρδιακή λειτουργία και καρδιακή αναδιαμόρφωση. Η ερευνητική μας ομάδα προχωράει στο σχεδιασμό και την εκτέλεση πολυκεντρικής κλινικής μελέτης φάσης ΙΙβ/ΙΙΙ σε συνεργασία με την εταιρεία Uni-Pharma Φαρμακευτικά Εργαστήρια προκειμένου να δείξει την ευεργετική δράση της Τ3 στους ασθενείς με έμφραγμα του μυοκαρδίου που υποβάλλονται σε επαναιμάτωση και να λάβει έγκριση στη συνέχεια από τις αρμόδιες ρυθμιστικές αρχές (FDA και ΕΜΑ) για να κυκλοφορήσει το φάρμακο.
2. Μελέτη των αναγεννητικών δράσεων της Τ3 αμέσως μετά το έμφραγμα του μυοκαρδίου σε επίμυες in vivo. Η μελέτη αυτή στοχεύει στην ανάδειξη νέων δράσεων της Τ3 και τη μελέτη σε βάθος των μηχανισμών που σχετίζονται με τα αποτελέσματα της κλινικής μελέτης Thy-Repair. Το πρωτόκολλο είναι ανάλογο της κλινικής μελέτης και διερευνάται η επίδραση διαφορετικών δόσεων της Τ3 στην λειτουργική, επουλωτική και αναγεννητική απάντηση της καρδιάς μετά την ισχαιμία. Χρησιμοποιούνται τεχνικές ανοσοιστοχημείας και ανοσοφθορισμού.
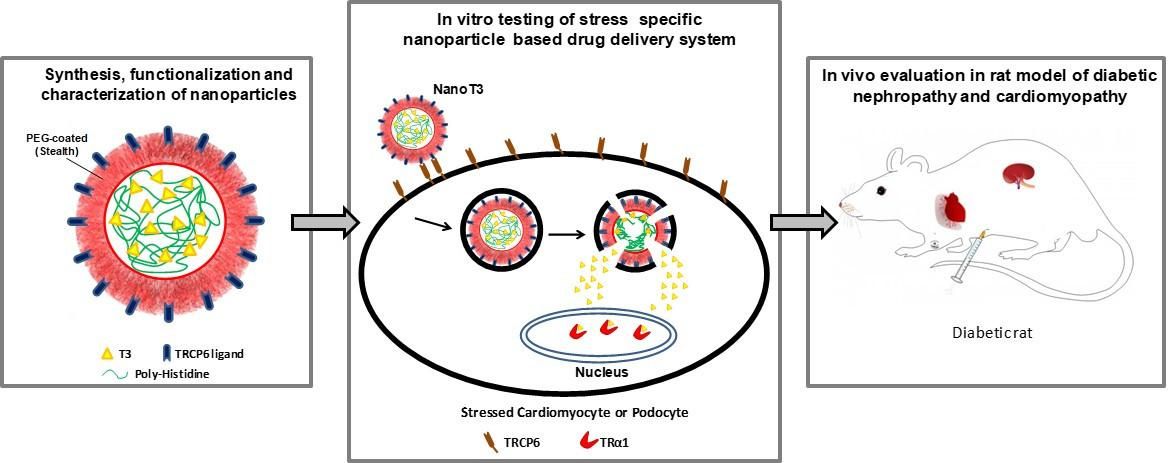
3. Ανάπτυξη νανοφορέων της Τ3 που στοχεύουν εκλεκτικά τα μυοκαρδιακά κύτταρα που βρίσκονται σε στρές. Οι νανοφορείς αυτοί θα μπορούν να μεταφέρουν την απαραίτητη θεραπευτική ποσότητα Τ3 στα κύτταρα που έχουν υποστεί στρες (και υπερεκφράζουν TRα1) ενώ δεν θα επηρεάζουν τα υγιή κύτταρα μειώνοντας πιθανές παρενέργειες. Η έρευνα αυτή χρηματοδοτείται στο πλαίσιο του Ευρωπαϊκού Ερευνητικού Προγραμμάτος α.“Regenerating the diabetic heart and kidney by using stress-specific thyroid hormone nanocarriers” (EURONANOMED2019-049 / REASON)
Εικόνα 4 . Σκεπτικό σχεδιασμού και δράσης των νανοσωματιδίων της Τ3 στη διαβητική καρδιομυοπάθεια και νεφροπάθεια.
4. Σχεδιασμός και σύνθεση αναλόγων της τριιωδοθυρονίνης με πιθανή εκλεκτική δράση αγωνιστή του TRα1 υποδοχέα. Στόχος των εκλεκτικών αγωνιστών του TRα1 υποδοχέα είναι να επάγουν ισχυρότερη καρδιοπροστασία έναντι της ισχαιμικής βλάβης και ιστική επιδιόρθωση/αναγέννηση με λιγότερες παρενέργειες από άλλα συστήματα. Οι ουσίες αυτές δοκιμάζονται σε μοντέλα καλλιεργειών μυοβλαστών και καρδιομυοκυττάρων και σε πειραματικά μοντέλα μυοκαρδιακής βλάβης και καρδιακής ανεπάρκειας στα πλαίσια της εκπόνησης 2 διδακτορικών διατριβών.
5. Φαρμακολογικές μέθοδοι προστασίας καρδιακών μοσχευμάτων. Η ψυχρή καρδιοπληγία αποτελεί αυτή τη στιγμή τη μέθοδο εκλογής για την προστασία και μεταφορά των μοσχευμάτων κατα την καρδιακή μεταμόσχευση. Η μέθοδος αυτή όμως έξασφαλίζει μικρής διάρκειας καρδιοπροστασία. Εναλλακτικά, τα μοσχεύματα μεταφέρονται σε ειδική συσκευή θερμής διαπότισης (organ care system, Transmedics Endover, MA, USA) με ταυτόχρονη παρακολούθηση των παραμέτρων λειτουργίας. Ωστόσο, η μέθοδος αυτή απαιτεί ένα διάλυμα διαπότισης που περιέχει συστατικά υψηλού κόστους και χρειάζεται να αναμιχθεί με οξυγονωμένο αίμα του δότη πράγμα που καθιστά τη μέθοδο πολύπλοκη. Η έρευνα μας έχει αναπτύξει ειδικό διάλυμα για μακροχρόνια ex vivo διατήρηση των καρδιακών μοσχευμάτων με απλή σύσταση και χαμηλό κόστος που δεν απαιτεί την ανάμειξη με οξυγονωμένο αίμα (μη δημοσιευμένα δεδομένα, το διάλυμα αυτό βρίσκεται σε διαδικασία κατοχύρωσης πατέντας).
6. Μελέτη των δράσεων της Τ3 ως θεραπευτικής προσέγγισης για τη μικροαγγειακή δυσλειτουργία και πολυοργανική ανεπάρκεια που προκαλεί η σήψη. Από μελέτες στο μυοκάρδιο δείχθηκε η σημαντική δράση της Τ3 στην μικροαγγειακή βλάβη μετά το έμφραγμα του μυοκαρδίου. Η δράση αυτή μπορεί να είναι ωφέλιμη και για τη μικροαγγεική δυσλειτουργία που προκαλεί η σήψη. Η μελέτη πραγματοποιείται σε in vivo μοντέλο περίδεσης και διάτρησης του τυφλού εντέρου σε μύες με την πρόκληση περιτονίτιδος και γίνεται σε συνεργασία με την εταιρεία Uni-Pharma Φαρμακευτικά Εργαστήρια. Μελετάται η παρουσία ιστικής υποξίας σε διάφορα όργανα με την καινοτόμο μέθοδο της ανοσοιστοχημείας που στηρίζεται στην πιμονιδαζόλη.
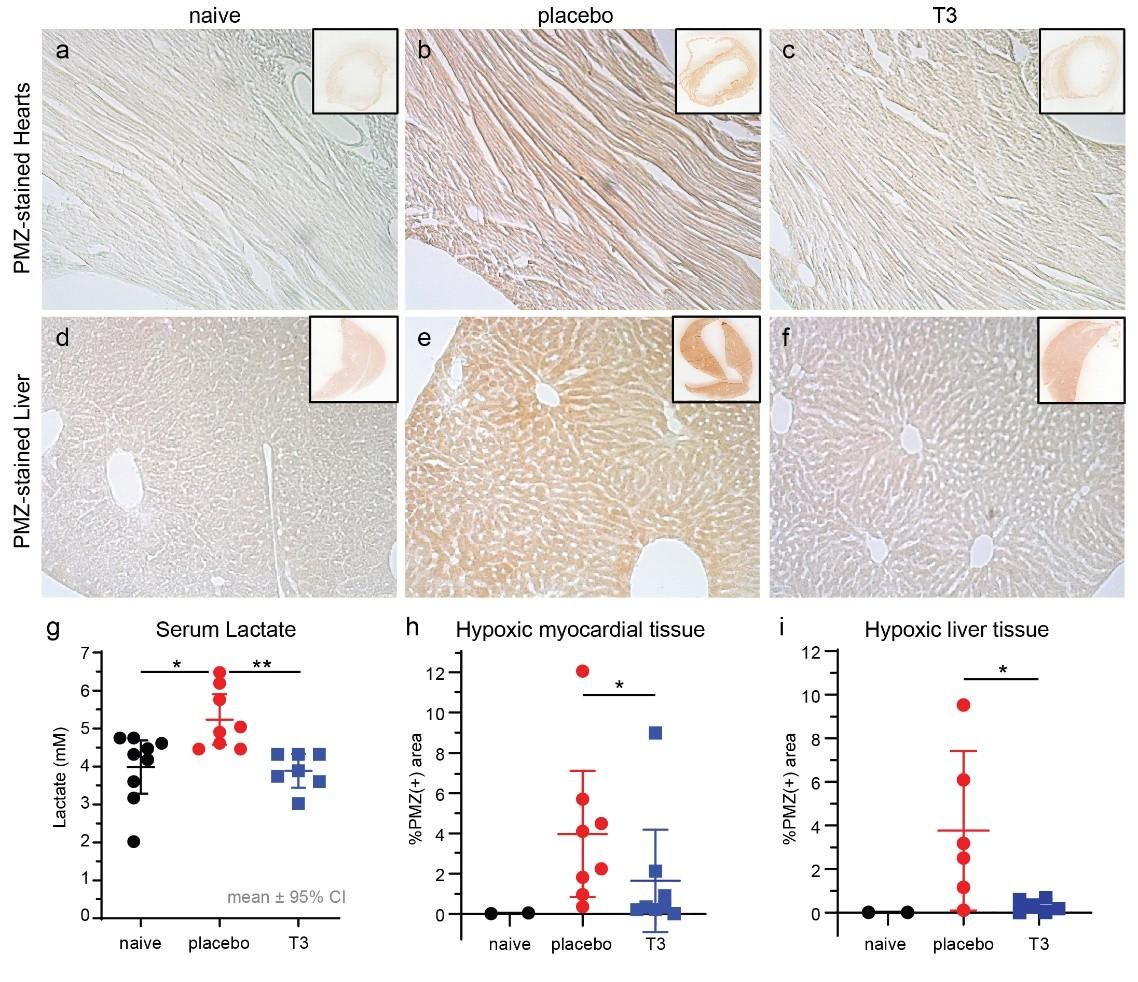
Εικόνα 5. Αντιπροσωπευτικές εικόνες μικροσκοπίας μετά από χρώση Πιμονιδαζόλης (PMZ) από ιστούς καρδιάς και ήπατος φυσιολογικών ζώων (α), σηπτικών ζώων με εικονικό φάρμακο (β) και σηπτικών ζώων με T3 (γ). Η ανίχνευση της υποξίας (ανίχνευση PMZ) βασίστηκε σε χρώση ανοσοϋπεροξειδάσης (καφέ χρώμα). (δ) Τα επίπεδα γαλακτικού στον ορό ήταν 5,2 ± 0,28 mM στην ομάδα του εικονικού φαρμάκου και 4,2 ± 0,35 στην ομάδα που έλαβε Τ3 18 ώρες μετά τη σήψη, p <0,05. Τα βασικά επίπεδα γαλακτικού σε φυσιολογικά ζώα ήταν 4,1 ± 0,3 mM, p <0,05 έναντι της ομάδας του εικονικού φαρμάκου μόνο. (ε) Ο ποσοτικός προσδιορισμός της θετικής στην υποξία χρώσης στον αριστερό κοιλιακό ιστό ήταν 4% ± 0,5 στο εικονικό φάρμακο και 1,5% ± 0,5 σε καρδιές που υποβλήθηκαν σε θεραπεία με Τ3, 18 ώρες μετά τη σήψη, p = 0,028. (στ) Η θετική στο PMZ χρώση στο ήπαρ ήταν 3,8% ± 1,4 στο εικονικό φάρμακο και 0,3% ± 0,1 στις καρδιές που έλαβαν Τ3, p= 0,026 (Intensive Care Med Exp. 2021 Dec; 9: 17) * p<0.05 vs placebo
Υπεύθυνος Επικοινωνίας #1
Υπεύθυνη Επικοινωνίας #2